
国立大学法人 京都工芸繊維大学 応用生物学 生体機能学研究室
Neuroscience Laboratory, Department of Applied Biology, Kyoto Institute of Technology

Research
--------------------------------------------------------------------------------------
1. 脳幹の神経幹細胞による修復機構
「脳幹の神経幹細胞は、機能維持や修復に関与しているのか!」
--------------------------------------------------------------------------------------
脳は大人になると新しい神経細胞などを作り出すことが出来ないと考えられてきた。しかし、今から20年ほど前に海馬(Subgranular zone :SGZ) や側脳室下帯(Subventricular zone :SVZ)に神経幹細胞が存在することが報告された。本研究室では新たに3か所神経幹細胞が存在し、脳がダメージを受けた時に新しい細胞を供給していることを調べています。


1)
大人になると脳には神経幹細胞は存在せず、新しい神経やグリア細胞は出来ないと考えられてきた。しかし、近年大人の海馬(SGZ)や側脳室下帯(SVZ)に神経幹細胞が存在することが発見され、神経科学会におけるトッピクスになった。
さらに、本研究室において、脳幹の脈絡終板器官(OVLT), 脳弓下器官(SFO), 最後野(AP) 中心管(CC)にも神経幹細胞が存在することが証明された(左図)。神経幹細胞は、部位特異的機能を有している。例えば、海馬(SGZ)は記憶、側脳室下帯(SVZ)は嗅覚情報の記憶に関与している。しかし、新しく発見されたこれら4部位の機能については、ほとんど明らかになっていない。
延髄には最後野(AP)にアストロサイト様の神経幹細胞、中心管(CC)にタニサイト様の神経幹細胞がある。中心管(CC)は延髄に幅広く分布しており、延髄全域への新しい細胞供給が可能である。


2)
中心管(CC)の神経幹細胞をNeurosphere assayにより培養すると、Sphere形成が確認された。また、プレートに接着させ成長因子がない状態で培養すると、アストロサイトやオリゴデンドロサイトへの分化が認められた(左図)。さらに、延髄に実験的に脳出血を起こさせると、神経幹細胞の増殖が促進され、損傷部位への新しい細胞の供給が観察された。このことから、延髄の神経幹細胞は、延髄の修復機能があることが示された。
References
1) Furube, E., Ishi, H., Numbu, Y., Kurganov, E., Nagaoka, S., Morita, M., Miyata, S., 2020. Neural stem cell phenotype in tanycyte-like ependymal cells in the circumventricular organs and central canal of adult mouse brain. Scientific Reports (2020) 10:2826.
2) Hiratsuka, D., Furube E., Morita, M., Miyata, S.Remyelination in the medulla oblongata of adult mouse brain during experimental autoimmune encephalomyelitis. Journal of Neuroimmunology (2018) 319: 41-54
3) Hiratsuka,D., Kurganov, E., Furube, E., Morita, M., Miyata, S. VEGF- And PDGF-dependent proliferation of oligodendrocyte progenitor cells in the medulla oblongata after LPC-induced focal demyelination. Journal of Neuroimmunology (2019) 332: 176-186.
4) Furube, E., Morita, M., Miyata, S. Characterization of neural stem cells and their progeny in the sensory circumventricular organs of adult mouse. Cell & Tissue Research (2015) 362: 347–365.
5) Hourai A, Miyata S (2013) Neurogenesis in the circumventricular organs of adult mouse brains. Journal of Neuroscience Research 91: 757–770.
---------------------------------------------------------------------------------------
2. 細菌感染時における脳の病原体関連分子受容体TLRsと温度感受性チャネルTRPの機能
「未だに未解明の炎症開始と体温調節機構!」
---------------------------------------------------------------------------------------
ヘッディング 1
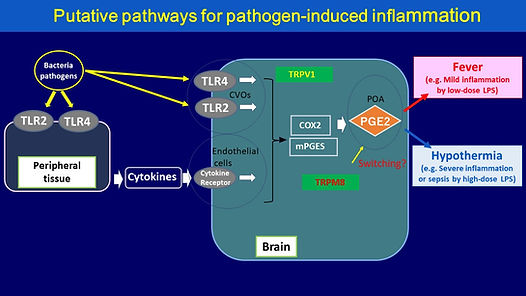
1) Tool-like Receptors (TLRs)は、細菌やウィルスの病原体関連分子パターン分子を認識して、感染情報を伝達する。また、Transient Receptor Potential Family Channel(TRPs)は、 温度感受性チャネルで温度受容と体温調節に関与している。本研究室では、脳に存在するTLRsが存在し病原体が侵入した際に、脳に感染情報を速やかに伝達する仕組みを調べています。さらに、感染による体温調節におけるTRPPV1やTRPM8の機能を調べています。
左図は、細菌感染時における末梢と脳を介した炎症開始機構と体温との関係を示したものです。右図は、TRP遺伝子を欠くノックアウトマウスはLPS投与により野生型に比べ、発熱温度が高いことを示している。

工事中
2)
TRPV1遺伝子を欠くノックアウトマウスを32.5℃の暑熱環境に暴露すると、体温を一定に保つことができず高体温をします(Aの赤線)。一方、野生型は、暑熱環境でも一定の体温をたもち恒常性を維持していることがわかる(Aの黒線)。なぜ、TRPV1遺伝子を欠くと体温を維持できないのか? そのメカニズムとして、唾液塗布(人では発汗に相当:Bの中央)や体を伸長して体表面積を増やす(Bの右)、放熱行動に異常があることが分かった(C: 定量結果)。

------------------------------------------------------------------------------------ 3. ミクログリア増殖の意義
-------------------------------------------------------------------------------------
References
1) Park Y, Miyata S, Kurganov E. TRPV1 is crucial for thermal homeostasis in the mouse by heat loss behaviors under warm ambient temperature. Scientific Reports (2020) 10: 8799.
2) Inagaki H, Kurganov E, Park Y, Furube E, Miyata S. Oral gavage of capsaicin causes TRPV1-dependent acute hypothermia and TRPV1-independent long-lasting increase of locomotor activity in the mouse. Physiology & Behavior (2019) 206:213-224.
3) Murayama, Kurganov E, Miyata S. Activation of microglia and macrophages in the circumventricular organs of the mouse brain during TLR2-induced fever and sickness responses. Journal of Neuroimmunology (2019) 334:576973.
4) Muneoka S, Murayama S, Nakano Y, Miyata S. TLR4 in circumventricular neural stem cells is a negative regulator for thermogenic pathways in the mouse brain. Journal of Neuorimmunology (2019) 331:58-73.
5) Yoshida A, Furube E, Mannari T, Takayama Y, Kittaka H, Tominaga M, Miyata S. TRPV1 is crucial for proinflammatory STAT3 signaling and thermoregulation-associated pathways in the brain during inflammation. Scientific Reports (2016) 6: 26088.
脳の免疫担当細胞であるミクログリアは、正常状態においては不必要な物質を除去したり、細胞を貪食することで、脳内環境恒常性維持のために重要な役割を担っています。しかし、脳疾病状態ではミクログリアの異常活性化や増殖による暴走が起き、病状の悪化を引き超すことが知られています。さらに、うつ病や統合失調症などの精神疾患は、脳が持続的炎症状態であると考えられており、精神疾患の発症が風邪などの感染・発熱により引き起こされる場合もあることが報告されています。例えば、慢性ストレス状況下では、軽い脳炎症の兆候である37~38℃の微熱が持続することが報告されています。今まで、ミクログリアの増殖は、脳梗塞やアルツハイマー病などの重度の脳疾病でおきるが、弱い脳の炎症ではおきないと信じられてきました。
本研究では、グラム陰性菌由来の発熱・炎症物質LPSを低用量投与し、発熱を伴う弱い炎症を引きおこさせ、マウス脳でミクログリアの増殖と密度を調べました。その結果、脳室周囲器官(血液脳関門を欠き、脳の炎症を開始する4か所の脳部位)、体温調節中枢(視索前野)、弓状核(摂食中枢)、孤束核(迷走神経統合中枢)において顕著なミクログリア増殖がおきていることが明らかになりました(左図)。さらに、発熱・炎症物質LPSを高用量投与して炎症を重症化させると、大脳や海馬などの一部の脳部位を除くほとんどすべての脳部位でミクログリアが増殖していることがわかりました(右図)。驚くべくことに、このミクログリア増殖は一過性で、炎症後3週間程度でミクログリア密度は正常レベルに戻っていました。
以上の研究結果は、風邪程度の軽い感染症でもミクログリアの増殖がおきていることを証明しました。このことは、脳のミクログリアが、今まで考えられていたよりも容易に増殖することを示しています。一方、ミクログリアが増殖し高密度状態が何らかの理由で元に戻らない場合は、暴走化し精神的脳疾病の発症につながる可能性があることを示唆しており、精神疾患発症機構解明の手がかりになると考えられます。

